乳腺癌的發病率逐年增高,并成爲中(zhōng)國女性發病率最高的惡性腫瘤,是人們常說的“紅顔殺手”。其中(zhōng),三陰性乳腺癌惡性程度較高,患者生(shēng)存預後較差,易出現早期複發和轉移,且既往缺乏有效的針對性治療策略,素有最“毒”乳腺癌之稱。近日,複旦大(dà)學腫瘤醫院邵志(zhì)敏教授、江一(yī)舟教授課題組攜手複旦大(dà)學基礎醫學院教育部/衛健委/醫科院醫學分(fēn)子病毒學重點實驗室趙超課題組,發現微生(shēng)物(wù)代謝産物(wù)氧化三甲胺(TMAO)可以激活抗腫瘤免疫,提高三陰性乳腺癌免疫治療療效。這意味着微生(shēng)物(wù)代謝産物(wù)TMAO有望成爲三陰性乳腺癌臨床免疫治療的新策略,助推免疫治療。該項重要研究成果已在北(běi)京時間3月12日淩晨在國際權威期刊Cell Metabolism(《細胞代謝》)以封面文章發表。

研究借助多維組學分(fēn)析發現,三陰性乳腺癌患者中(zhōng)免疫調節亞型(Immunomodulatory, IM。即,對免疫治療可産生(shēng)應答組)的乳腺微環境中(zhōng),梭菌目下(xià)菌屬的占比顯著高于其他亞型患者,提示瘤内共生(shēng)菌群可能與抗腫瘤免疫應答有關。結合代謝數據分(fēn)析發現,梭菌相關代謝産物(wù)TMAO在IM亞型患者中(zhōng)的豐度更高,且與微環境内CD8+ T細胞比例和gamma幹擾素表達量成正相關。體(tǐ)内外(wài)實驗證明,組織内TMAO誘導乳腺癌細胞發生(shēng)由GSDME介導的焦亡,向微環境内釋放(fàng)大(dà)量炎性因子,從而實現對腫瘤特異性CD8+ T細胞募集和功能活化。同時發現,TMAO可活化内質網應激相關的PERK蛋白(bái),繼而切割GSMDE的上遊蛋白(bái)caspase-3誘導腫瘤細胞發生(shēng)焦亡。通過給小(xiǎo)鼠喂食TMAO前體(tǐ)物(wù)膽堿可提高血漿和瘤内TMAO水平,激活三陰性乳腺癌抗腫瘤免疫,提高免疫治療療效。因此,補充膽堿攝入可以作爲提高三陰性乳腺癌免疫治療療效的臨床潛在治療策略。
與常見文章報道的抗腫瘤激活劑直接作用于免疫細胞發揮作用不同,該研究從獨特角度出發,發現特殊微生(shēng)物(wù)群落借助代謝産物(wù)直接作用于腫瘤細胞,誘導其焦亡,繼而促進免疫細胞浸潤,最終發揮抗腫瘤作用。該研究,提出一(yī)種菌群促進細胞微環境炎性浸潤的新機制,爲提升特異性免疫應答效率提供了全新的思路。
“乳腺癌像一(yī)個‘大(dà)家族’,可細分(fēn)爲腔面A、腔面B、HER-2陽性和三陰性四大(dà)亞型,其中(zhōng)三陰性乳腺癌是最‘毒’的一(yī)種,”項目主要研究者邵志(zhì)敏教授表示,“三陰性乳腺癌占乳腺癌總體(tǐ)人群的10%-20%,其雌激素受體(tǐ)、孕激素受體(tǐ)以及HER-2表達均爲陰性。與其他三種乳腺癌亞型相比,三陰性乳腺癌患者生(shēng)存預後較差。”
近年來,以PD-1抑制劑爲代表的免疫治療成爲三陰性乳腺癌頗具前景的治療手段。但即便如此,随着臨床研究的不斷深入,仍有相當一(yī)部分(fēn)患者難以從免疫治療中(zhōng)獲益。爲了進一(yī)步提高精準治療療效,複旦大(dà)學腫瘤醫院邵志(zhì)敏教授、江一(yī)舟教授團隊于2019年提出“複旦分(fēn)型”,發現三陰性乳腺癌中(zhōng)有一(yī)類獨特的免疫調節亞型(Immunomodulatory, IM),其患者有較爲活化的免疫微環境特征,能夠從免疫治療中(zhōng)獲益。“如何提高三陰性乳腺癌免疫治療療效,是亟待解決的臨床難題。”邵教授評價道。
獨特視角揭示新策略:小(xiǎo)小(xiǎo)細菌成免疫治療關鍵“援軍”
既往研究中(zhōng),各國科學家從人體(tǐ)本身的角度對免疫治療進行研究,嘗試通過調控腫瘤細胞和免疫細胞來提高免疫治療療效,但他們往往忽視了一(yī)個重要的角色——共生(shēng)細菌。人體(tǐ)中(zhōng)生(shēng)活着大(dà)量的細菌,在正常情況下(xià),這些細菌與人體(tǐ)共生(shēng),并對于維持人體(tǐ)健康發揮着重要作用,這類細菌也被稱作共生(shēng)細菌。
研究表明,人體(tǐ)乳腺組織中(zhōng)也存在着共生(shēng)細菌群。無論是正常乳腺組織還是患有乳腺癌的乳腺組織,這類共生(shēng)菌群都是細胞微環境的重要組成部分(fēn)。那麽在腫瘤細胞與免疫細胞戰鬥的戰場上,共生(shēng)菌群這支神秘的部隊究竟是“敵”是“友”,是否在抗擊腫瘤中(zhōng)發揮了作用?
爲了探究這個科學問題,團隊基于複旦大(dà)學附屬腫瘤醫院三陰性乳腺癌隊列,通過多組學維度進行分(fēn)析,發現免疫調節亞型(IM)患者的乳腺微環境中(zhōng)梭菌目菌屬的占比顯著高于其他亞型患者,提示瘤内共生(shēng)菌群可能影響三陰性乳腺癌的腫瘤微環境。結合代謝數據分(fēn)析發現,梭菌相關代謝産物(wù)TMAO同樣在IM亞型患者中(zhōng)有着更高的豐度,且與微環境内CD8+ T細胞比例成正相關,而CD8+ T正是人體(tǐ)發揮抗腫瘤功能的關鍵“戰士”。因此,梭菌目共生(shēng)菌和相關代謝産物(wù)TMAO是人體(tǐ)抗擊三陰性乳腺癌的“友軍”。
團隊進一(yī)步探究TMAO是如何幫助人體(tǐ)抑制三陰性乳腺癌的。研究團隊基于小(xiǎo)鼠動物(wù)模型開(kāi)展相關實驗,發現上調瘤内TMAO水平可以通過增加瘤内微環境中(zhōng)CD8+ T細胞的浸潤,激活CD8+ T細胞的功能并有效抑制三陰性乳腺癌的生(shēng)長。機制探索發現,TMAO誘導乳腺癌細胞發生(shēng)由GSDME介導的焦亡,向微環境内釋放(fàng)大(dà)量炎性因子,從而增加微環境中(zhōng)CD8+ T細胞的浸潤,并激活CD8+ T細胞發揮抗腫瘤功能。研究同時發現,TMAO誘導的腫瘤細胞焦亡與内質網應激密切相關。TMAO通過活化PERK蛋白(bái),進一(yī)步切割GSMDE的上遊蛋白(bái)caspase-3誘導腫瘤細胞發生(shēng)焦亡。
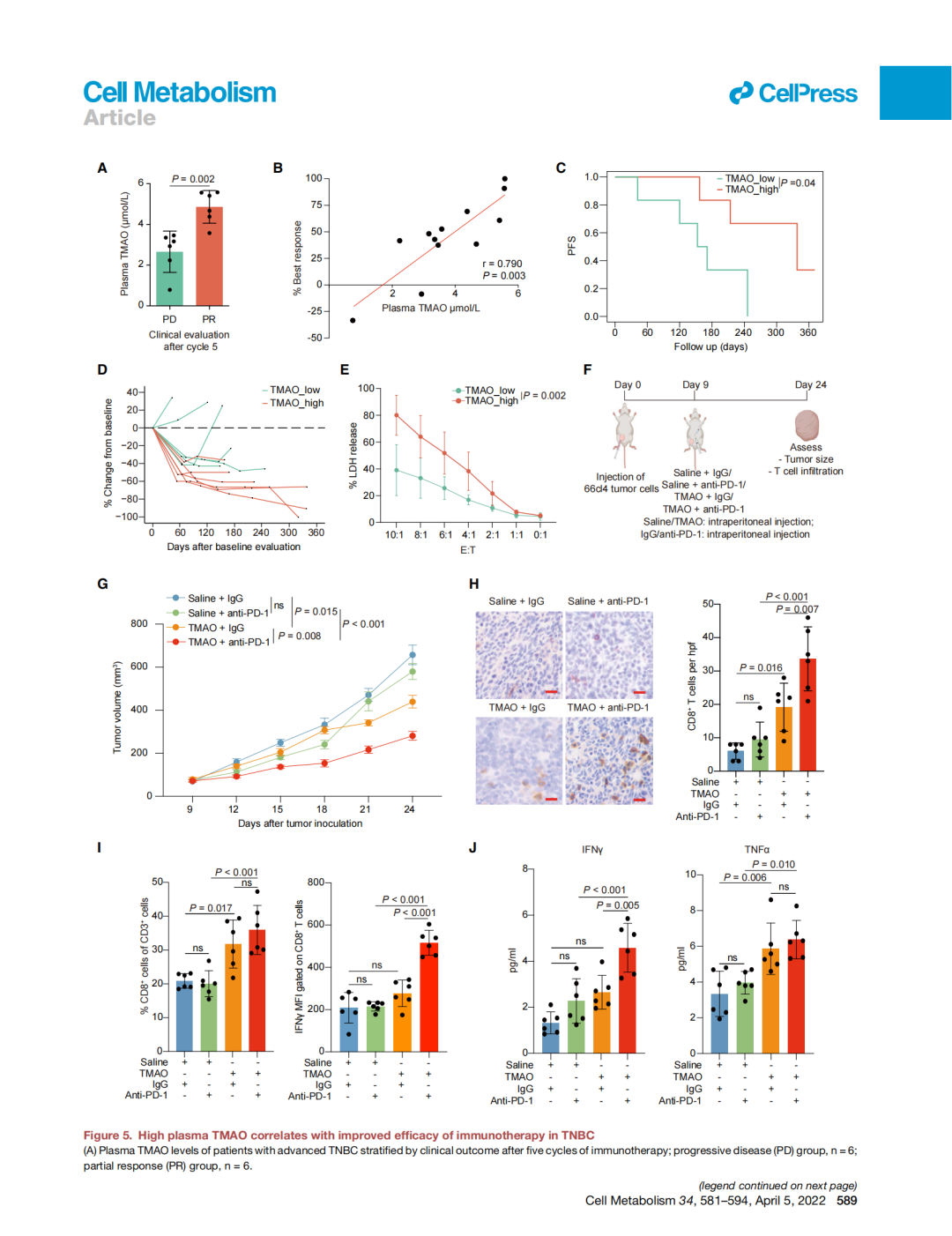
在發現這個令人振奮的科學現象後,團隊也積極推進轉化性研究。結合臨床三陰性乳腺癌免疫治療隊列,研究團隊發現,高血漿TMAO水平的患者對免疫治療反應性更好,且小(xiǎo)鼠體(tǐ)内實驗同時證實提高血漿TMAO水平可以有效抑制小(xiǎo)鼠腫瘤的生(shēng)長。爲了探究臨床可及的治療方案,研究團隊通過給小(xiǎo)鼠喂食TMAO前體(tǐ)代謝産物(wù)膽堿提高血漿TMAO和瘤内水平,并且證實補充膽堿攝入可以激活三陰性乳腺癌抗腫瘤免疫,提高免疫治療療效。
膽堿是人體(tǐ)日常攝入的營養物(wù)質之一(yī),常見于蛋白(bái)、魚肉、牛肉中(zhōng),安全性較好,在以往臨床中(zhōng)常被用作營養補劑。因此,補充膽堿攝入有望成爲提高三陰性乳腺癌免疫治療療效的臨床潛在治療策略。邵教授團隊也已開(kāi)啓口服膽堿提高三陰性乳腺癌免疫治療療效的臨床試驗,希望能夠推動三陰性乳腺癌免疫治療的發展。
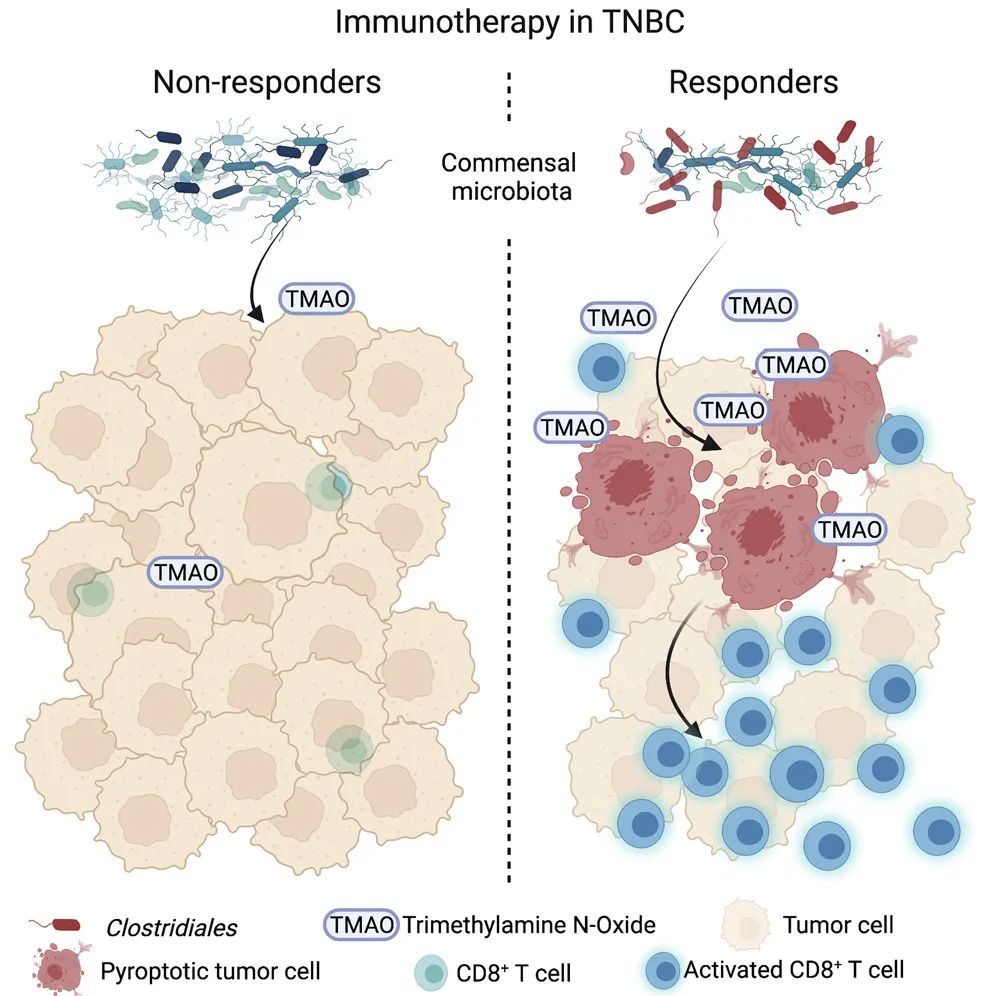
圖1 菌群通過代謝産物(wù)TMAO促抗腫瘤免疫示意圖“在‘複旦分(fēn)型’的基礎上,我(wǒ)們從微生(shēng)物(wù)代謝組的獨特角度出發,聚焦免疫治療的臨床問題,發現微生(shēng)物(wù)代謝産物(wù)TMAO可以激活三陰性乳腺癌抗腫瘤免疫,并提高免疫治療療效。”邵教授表示,“該研究進一(yī)步完善了複旦大(dà)學附屬腫瘤醫院乳腺外(wài)科“臨床問題-科學研究-臨床實踐”的體(tǐ)系,爲三陰性乳腺癌精準免疫治療提供了新的策略。也希望這項研究能夠在臨床實踐中(zhōng)提高免疫治療療效,切實地幫助三陰性乳腺癌患者。








在線咨詢
技術支持





