

技術專欄
細胞死亡新方式 | 銅死亡
(1) 銅離(lí)子在細胞生(shēng)理過程中(zhōng)的重要作用
細胞死亡是一(yī)種正常的生(shēng)命現象,其相關研究一(yī)直是生(shēng)命科學領域的熱點。與鐵相似,銅也是所有生(shēng)物(wù)體(tǐ)内不可缺少的一(yī)種微量元素,在常規的化學反應和生(shēng)理條件下(xià),還原型Cu+可轉變爲氧化型Cu2+。銅離(lí)子可與多種蛋白(bái)質或酶結合,作爲輔助因子或結構組成部分(fēn),參與調控能量代謝、線粒體(tǐ)呼吸和抗氧化等多個生(shēng)理過程。
(2)銅死亡(Cuproptosis):一(yī)種新型受控性細胞死亡機制
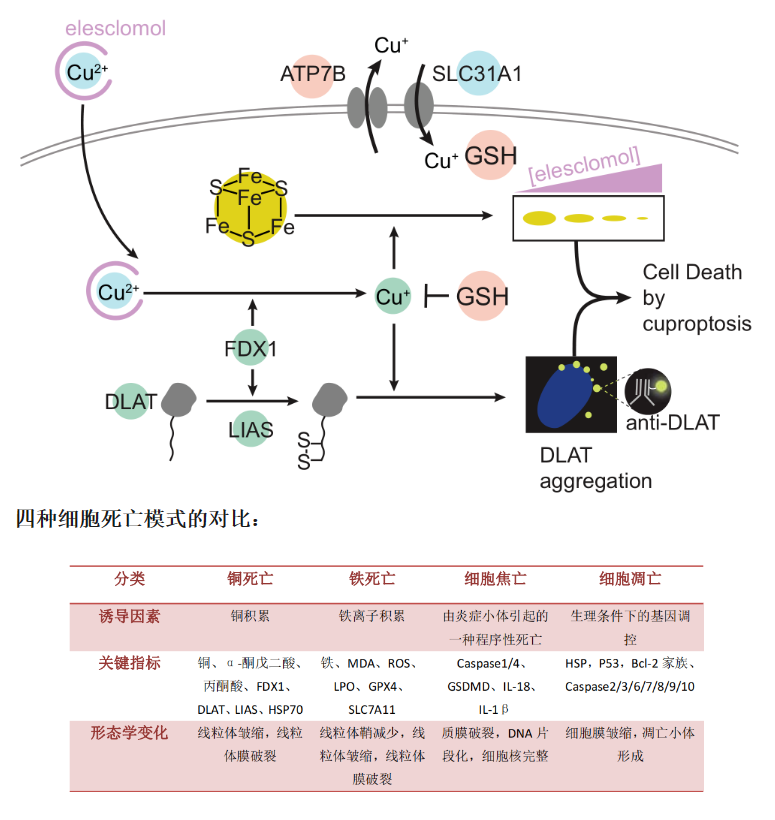
2022年3月在《Science》上發表題爲Copper induces cell death by targeting lipoylated TCA cycle proteins的文章中(zhōng),研究人員(yuán)将一(yī)種發生(shēng)機制明顯區别于已知(zhī)的細胞凋亡、細胞焦亡及鐵死亡的受控性細胞死亡方式,命名爲“銅死亡”(Cuproptosis)。研究人員(yuán)發現銅死亡依賴于線粒體(tǐ)呼吸--銅離(lí)子通過直接結合三羧酸循環途徑中(zhōng)的硫辛酰化蛋白(bái),導緻硫辛酰化蛋白(bái)異常聚集,并幹擾呼吸鏈複合體(tǐ)中(zhōng)的鐵硫簇蛋白(bái),進而引發蛋白(bái)質毒性應激,最終緻使細胞死亡。
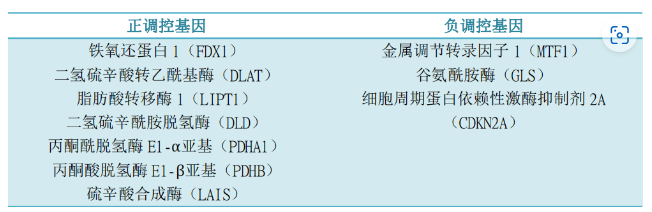
(3)10個與銅死亡相關的基因
1.線粒體(tǐ)呼吸調節銅離(lí)子載體(tǐ)誘導的細胞死亡研究發現,用銅離(lí)子載體(tǐ)處理不會顯著降低基礎呼吸或ATP相關呼吸,但會顯著降低呼吸的儲備能力,這表明銅不直接靶向ETC,而是靶向TCA循環的組成部分(fēn)。
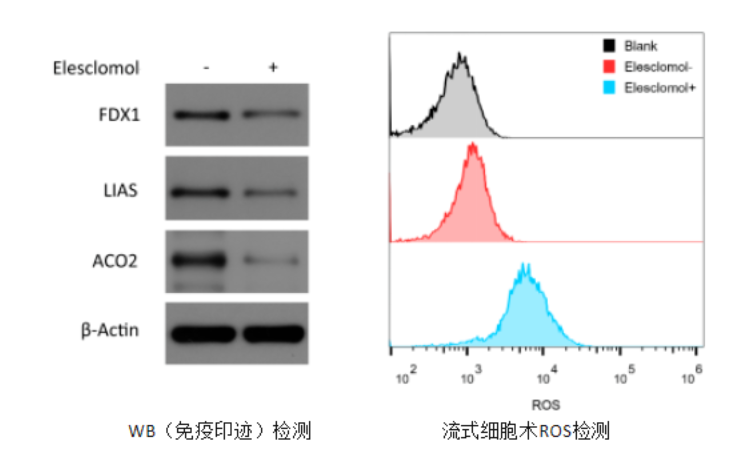
2.銅死亡的關鍵調控基因FDX1,是蛋白(bái)質脂化的上遊調節因子爲了确定介導銅毒性的特定代謝途徑,研究者通過CRISPR基因敲除篩選發現,敲除FDX1會減弱銅離(lí)子載體(tǐ)誘導的細胞死亡。
3.銅直接結合并誘導脂酰化DLAT的寡聚化蛋白(bái)質的硫辛酰化修飾是結合銅的必要條件。銅與硫辛酰化蛋白(bái) DLAT 的結合,會導緻蛋白(bái)的寡聚化,而 Elesclomol 處理會增加 DLAT 蛋白(bái)的寡聚化。
(4)銅催化氧化應激
-
銅介導Fenton反應催化合成最活躍的羟基自由基,從而導緻細胞中(zhōng)的ROS濃度升高,導緻細胞死亡。此外(wài)銅可以将還原的谷胱甘肽氧化成氧化型谷胱甘肽二硫物(wù)(oxidizedglutathionedisulfide,GSSG),導緻抗氧化劑谷胱甘肽的耗竭,從而幹擾谷胱甘肽相關的抗氧化防禦系統,由此導緻細胞死亡。
-
研究表明銅螯合劑伊利司莫(Elesclomol,ES),一(yī)種高度親脂性的銅結合分(fēn)子,它可以螯合細胞外(wài)的Cu2+,形成一(yī)種以ES-Cu2+複合物(wù)的形式,将銅輸送到線粒體(tǐ)中(zhōng)産生(shēng)氧化應激從而觸發細胞凋亡。
(5)銅死亡在腫瘤中(zhōng)的相關研究
銅離(lí)子的含量維持動态平衡,失衡可導緻氧化應激和細胞自噬異常等,從而誘發多種銅或銅離(lí)子相關性疾病的發生(shēng)。
-
乳腺癌 有研究表明乳腺癌患者血清中(zhōng)Cu2+含量高于正常人。乳腺癌線粒體(tǐ)中(zhōng)銅伴侶蛋白(bái)COX17和SCO2表達上調,這說明乳腺癌細胞比正常細胞對銅向線粒體(tǐ)運輸的需求更高。
-
結直腸癌 銅與腫瘤微環境中(zhōng)的炎症因子相互作用,炎症因子IL-17通過誘導STEAP4來推動細胞對銅的攝取,從而促進了結直腸癌的發生(shēng)。因此細胞銅代謝狀态可能是癌細胞對IL-17刺激反應的關鍵因素。
-
肺癌 有研究表明生(shēng)理濃度的Cu2+聯合Disulfiram對非小(xiǎo)細胞肺癌細胞有選擇毒性。
-
參考文獻:
[1] Tsvetkov P, Coy S, Petrova B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science. 2022;375(6586):1254-1261.
-
在線咨詢
Online consultation
-
在線咨詢
-
技術支持

關注微信公衆号



