

技術專欄
鐵死亡在肝纖維化治療中(zhōng)的作用機制
2012年,哥倫比亞大(dà)學Brent R. Stockwell團隊首次提出了一(yī)種名爲鐵死亡的新型細胞程序性死亡方式。從此,鐵死亡相關研究熱潮逐年攀升。這期小(xiǎo)編将帶領大(dà)家探究鐵死亡調控與肝纖維化的作用機制。

與細胞凋亡和細胞自噬不同,鐵死亡是一(yī)種依賴鐵的過程。鐵死亡的本質是谷胱甘肽(GSH)的耗竭和谷胱甘肽過氧化物(wù)酶4(GPX4)活性的降低。當谷胱甘肽過氧化物(wù)無法被GPX4催化還原,脂質過氧化物(wù)将無法代謝,從而破壞細胞膜的完整性,導緻細胞死亡。鐵死亡在形态學、生(shēng)物(wù)化學和遺傳學上有其獨特的表征。
● 形态特征
● 生(shēng)化特征
鐵聚積,脂質過氧化,絲裂原活化蛋白(bái)酶(MAPKs)系統激活,胱氨酸-谷氨酸反向轉運體(tǐ)(System Xc-,由SLC7A11的SLC3A2組成的異二聚體(tǐ))抑制胱氨酸攝取降低,谷胱甘肽(GSH)耗竭,NAPDH氧化增加,釋放(fàng)花生(shēng)四烯酸介質(如11-HETE和15-HETE)等。
●免疫特征
釋放(fàng)損傷相關的分(fēn)子模式(DAMPs),促進炎症反應。
鐵代謝與鐵死亡
鐵死亡與肝纖維化
纖維化疾病由細胞經曆持續慢(màn)性損傷的複雜(zá)病理過程發展而來,鐵死亡相關機制在纖維化疾病進展中(zhōng)發揮重要的調控作用。肝纖維化的主要病理特征是肝髒内HSC的活化與ECM過度沉積,彙管區大(dà)量纖維結締組織異常增生(shēng),進而破壞肝髒正常結構以及生(shēng)理功能。因此,抑制HSC的活化及增殖,誘導HSC死亡是治療肝纖維化的有效方法。研究表明,HSC中(zhōng)儲存有大(dà)量的鐵離(lí)子,鐵死亡可以通過調控HSC内鐵離(lí)子含量以及脂質過氧化程度等影響肝纖維化的發展進程,因此靶向HSC鐵死亡可能成爲治療肝纖維化的新策略[1](圖1)。
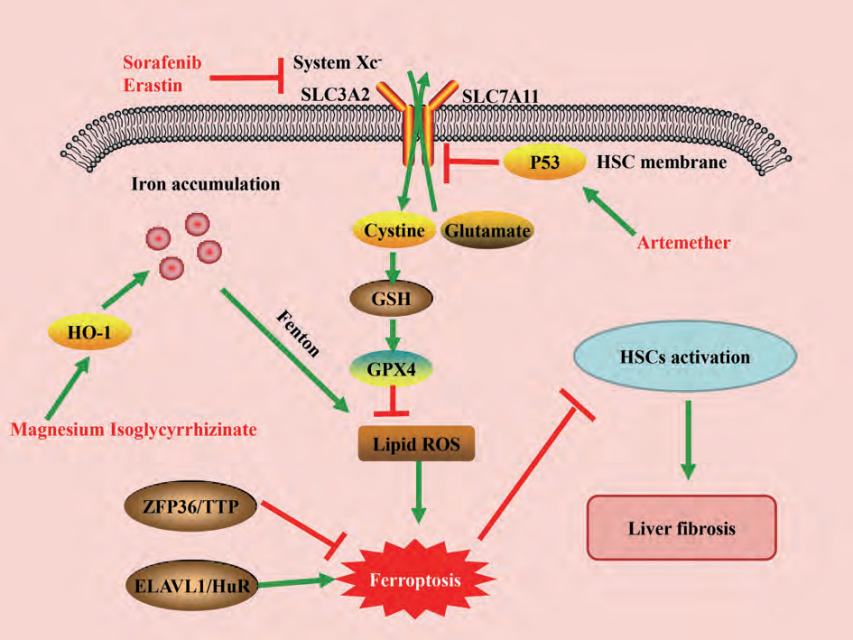
圖1:鐵死亡在肝纖維化中(zhōng)的相關調控途徑

01 RNA結合蛋白(bái)ZFP36/TTP和ELAVL1/HuR調控鐵死亡
Sui等[2]研究發現在大(dà)鼠肝纖維化模型中(zhōng),異甘草酸鎂可誘導 HO-1上調,促進鐵和脂質過氧化物(wù)的積累,從而促進HSC鐵死亡的發生(shēng);而通過鐵死亡抑制劑ferrostatin-1或沉默HO-1則消除了異甘草酸鎂的抗纖維化作用。鋅指蛋白(bái)36(ZFP36 ring finger protein 36,ZFP36/TTP)和胚胎緻死性異常視覺樣蛋白(bái)1(ELAV like RNA binding protein 1,ELAVL1/HuR) 在調控HSC鐵死亡中(zhōng)發揮重要作用,下(xià)調 ZFP36和上調ELAVL1可以促進索拉非尼(sorafenib)/erastin介導的HSC鐵死亡,減輕小(xiǎo)鼠肝纖維化,進一(yī)步機制研究發現ZFP36/ELAVL1可能與下(xià)遊靶基因結合,影響其mRNA穩定性,從而調控HSC中(zhōng)儲鐵蛋白(bái)自噬,釋放(fàng)出鐵離(lí)子,繼而通過芬頓反應産生(shēng)大(dà)量ROS,促進HSC鐵死亡[3,4] 。
02 BRD7-P53-SLC25A28軸和Trf調控鐵死亡
Zhang等[5]研究發現采用CRISPR/cas9介導的BRD7敲除可減少HSC鐵死亡,而特異性BRD7質粒介導的BRD7過表達可促進HSC鐵死亡,進一(yī)步研究發現BRD7表達升高可通過直接與P53 N-末端轉激活域結合促進P53線粒體(tǐ)轉位,從而與下(xià)遊SLC25A28相互作用形成複合物(wù)來介導鐵死亡的發生(shēng)。研究者發現小(xiǎo)鼠肝細胞特異性敲除Trf表現爲肝髒非轉鐵蛋白(bái)結合鐵蓄積,加重高鐵飲食介導的肝纖維化,而同時特異性敲除小(xiǎo)鼠肝細胞Trf和溶質載體(tǐ)家族39成員(yuán)14(solute carrier family 39 member 14,SLC39A14) 可顯著減少肝髒鐵的積聚,改善了高鐵膳食或四氯化碳注射介導的肝纖維化,這些數據表明肝髒轉鐵蛋白(bái)在維持肝功能方面發揮保護作用,爲預防鐵過載誘導的肝纖維化提供了一(yī)個潛在治療靶點[6]。
03 P62-Keap1-Nrf2信号通路調控鐵死亡
目前研究認爲,鐵死亡的最終執行機制是由于過量的脂質過氧化物(wù)累積引起質膜損傷,造成細胞鐵死亡的發生(shēng)。Sun等[7]研究報道,沉默P62表達會增加erastin/sorafenib誘導的肝細胞癌(hepatocellular carcinoma,HCC) 細胞鐵死亡。此外(wài),在HCC細胞移植瘤小(xiǎo)鼠模型以及細胞實驗中(zhōng)發現,核因子E2-相關因子2(nuclear factor erythroid 2-related factor 2,Nrf2) 敲低也表現出增強erastin/sorafenib抗HCC的作用。這些結果表明,P62-Kelch樣ECH關聯蛋白(bái)1(Kelch-like ECH-associating protein 1,Keap1)-Nrf2信号通路可能在鐵死亡中(zhōng)發揮重要作用。因此,Nrf2可能是參與鐵死亡及未來治療多種肝病的重要靶點。

01 靶向system Xc-誘導鐵死亡
目前研發發現鐵死亡誘導劑主要是通過靶向system Xc-、GSH、GPX4 以及鐵離(lí)子和ROS實現誘導鐵死亡,其中(zhōng)erastin是最早确定的一(yī)種特異性鐵死亡誘導劑,可靶向抑制system Xc-的活性,影響GSH的合成,促進多種細胞發生(shēng)鐵死亡[8]。
02 靶向鐵離(lí)子和 ROS誘導鐵死亡
研究顯示,青蒿素和青蒿荜茇酰胺等多種中(zhōng)藥可以通過提高ROS含量,從而影響鐵代謝來誘導鐵死亡,發揮抗肝癌的作用且毒性較低,是非常有前景的藥物(wù)[9]。FINO2 是一(yī)類具有1,2-二氧戊烷結構的plakinic酸D衍生(shēng)物(wù),可通過發生(shēng)類芬頓反應,間接失活GPX4以及直接氧化PUFA的作用誘導細胞鐵死亡,且其在鐵水平高的腫瘤細胞中(zhōng)作用更強[10]。
03 靶向GSH誘導鐵死亡
丁胱亞磺酰亞胺通過抑制GSH合成限速酶-谷氨酰半胱氨酸連接酶(gluta‐mate-cysteine ligase, GCL),降低GSH水平和GPX4活性來促進脂質過氧化,進而誘導多種癌細胞發生(shēng)鐵死亡。順鉑可與GSH直接結合形成Pt(鉑)-GSH複合物(wù),導緻GSH和GXP4失活,從而促進鐵死亡。研究者進一(yī)步使用順鉑與erastin聯合作用于人肺癌細胞和人結腸癌細胞後發現,聯合用藥呈現出顯著的協同抗腫瘤效應[11]。
04 靶向脂質過氧化抑制鐵死亡
糙米提取物(wù)可以通過抑制鐵死亡來改善GPX4失活導緻的脂質過氧化和細胞毒性[12];黃芩苷也可以通過抑制脂質過氧化,減少遊離(lí)鐵蓄積而抑制鐵死亡,且其抑制作用明顯優于一(yī)些典型的鐵死亡抑制劑[13]。
05 靶向 ACSL4抑制鐵死亡
噻唑烷二酮類藥物(wù)羅格列酮、吡格列酮和曲格列酮等可特異性抑制ACSL4表達,從而保護細胞免受 RSL3誘導的鐵死亡和脂質過氧化。其中(zhōng),曲格列酮雖抑制ACSL4的效應較低,但可能由于其6-色原烷醇結構而具有固有的抗氧化活性,是噻唑烷二酮類藥物(wù)中(zhōng)抑制鐵死亡作用最強的[14]。一(yī)些研究者還将納米技術與鐵死亡研究相結合,利用納米材料抑制或誘發鐵死亡。因此,探索鐵死亡誘導劑和抑制劑的作用機制及開(kāi)發新的靶向鐵死亡藥物(wù)對于治療肝纖維化具有重要意義。

作爲生(shēng)命科學及醫學領域的蛋白(bái)抗體(tǐ)供應商(shāng),ELK biotechnology可爲鐵死亡相關研究提供高品質的試劑,這裏将鐵死亡部分(fēn)産品列出來以便大(dà)家參考,詳情見下(xià)表:
【參考文獻】
[1] Anderson ER, Shah YM. Iron homeostasis in the liver [J]. Compr Physiol, 2013, 3: 315-330.
[2] Sui M, Jiang X, Chen J, et al. Magnesium isoglycyrrhizinate ameliorates liver fibrosis and hepatic stellate cell activation by regulating ferroptosis signaling pathway [J]. Biomed Pharmaco‐ ther, 2018, 106: 125-133.
[3] Zhang Z, Yao Z, Wang L, et al. Activation of ferritinophagy is required for the
RNA-binding protein ELAVL1/HuR to regulate ferroptosis in hepatic stellate cells [J]. Autophagy, 2018, 14: 2083-2103.
[4] Zhang Z, Guo M, Li Y, et al. RNA-binding protein ZFP36/TTP protects against ferroptosis by regulating autophagy signaling pathway in hepatic stellate cells [J]. Autophagy, 2020, 16: 1482- 1505.
[5] Zhang Z, Guo M, Shen M, et al. The BRD7-P53-SLC25A28 axis regulates ferroptosis in hepatic stellate cells [J]. Redox Biol, 2020, 36: 101619.
[6] Yu Y, Jiang L, Wang H, et al. Hepatic transferrin plays a role in systemic iron homeostasis and liver ferroptosis [J]. Blood, 2020, 136: 726-739.
[7] Sun X, Ou Z, Chen R, et al. Activation of the p62-Keap1-NRF2 pathway protects against ferroptosis in hepatocellular carcinoma cells [J]. Hepatology, 2016, 63: 173-184.
[8] Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death [J]. Cell, 2012, 149: 1060-1072.
[9] Ooko E, Saeed ME, Kadioglu O, et al. Artemisinin derivatives induce iron-dependent cell death (ferroptosis) in tumor cells [J]. Phytomedicine, 2015, 22: 1045-1054.
[10] Abrams RP, Carroll WL, Woerpel KA. Five-membered ring peroxide selectively initiatesferroptosis in cancer cells [J]. ACS Chem Biol, 2016, 11: 1305-1312.
[11] Guo J, Xu B, Han Q, et al. Ferroptosis: a novel anti tumor action for cisplatin [J]. Cancer Res Treat, 2018, 50: 445-460.
[12] Xu WH, Li CH, Jiang TL. Ferroptosis pathway andits interven‐ tion regulated by Chinese materia medica [J]. China J Chin Mater Med (中(zhōng)國中(zhōng)藥雜(zá)志(zhì)), 2018, 43: 4019-4026.
[13] Xie Y, Song X, Sun X, et al. Identification of baicalein as a ferroptosis inhibitor by natural product library screening [J]. Biochen Biophys Res Commun, 2016, 473: 775-780.
[14] Doll S, Proneth B, Tyurina YY, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition [J]. Nat Chem Biol, 2017, 13: 91-98.
[15] Chen Hao, Li Xiaofeng, Wang Hua. Research progress on the mechanism of iron death in regulating liver fibrosis [J]. Acta Pharmacologica Sinica, 2019,56(11):2916-2922.DOI:10.16438/J.0513-4870.2021-0959.
在線咨詢
Online consultation
-
在線咨詢
-
技術支持

關注微信公衆号



